Es sobradamente conocido que el cáncer es una de las principales causas de muerte en los países desarrollados. Por poner algún número, en Europa el cáncer es el responsable de alrededor del 25% de las muertes. La radioterapia es una de las opciones de tratamiento, junto con la cirugía o la quimioterapia. Se calcula que 2 de cada 3 pacientes con cáncer recibirán radioterapia en algún momento de su tratamiento. Y, aunque no lo sepan, todos ellos pasaran por las manos de al menos un radiofísico.
¿En qué consiste la radioterapia? A primera vista es sencillo: consiste en irradiar el tumor con una fuente de radiación ionizante, entendiendo por radiación ionizante aquella que es capaz de arrancar electrones de los átomos y por tanto dañar el ADN de las células y destruirlas. Las células que forman los tumores son más sensibles a la radiación que las células normales lo que permite utilizar la radiación ionizante para tratar el cáncer, siendo de vital importancia administrar al tumor la dosis necesaria de radiación manteniendo al mínimo la dosis administrada al tejido circundante sano.
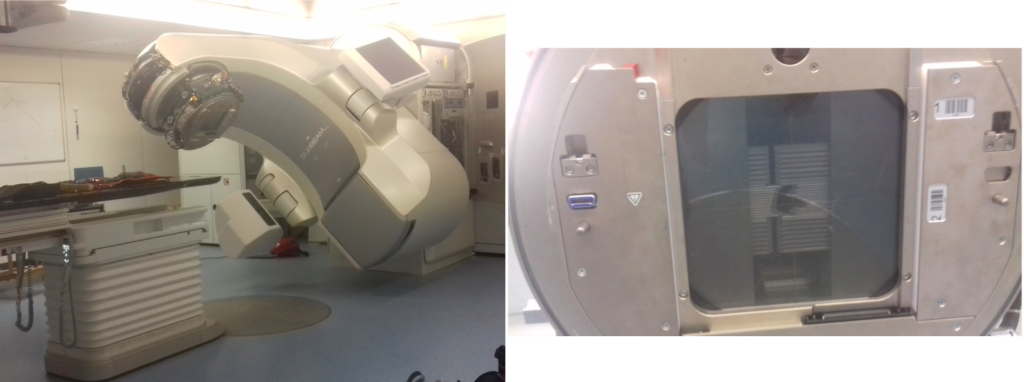
Ahora bien, esta irradiación puede realizarse de forma interna o externa. Cuando hablamos de radioterapia normalmente nos referimos a radioterapia externa donde usamos un acelerador de electrones, como el de la Figura 1. Los electrones acelerados chocan contra un blanco situado en el cabezal del equipo produciendo un haz de fotones de alta energía. Por el contrario, la radioterapia interna1 se basa en la acumulación en el tumor de sustancias radiactivas que son administradas al paciente y que se “diluyen” en él.
En radioterapia interna se utilizan generalmente emisores beta, es decir, núcleos radiactivos que se desintegran emitiendo electrones. Los electrones no pueden viajar muy lejos en un medio así que la energía liberada se deposita rápidamente. Por ello, cuando el radioisótopo no se administra localmente en el blanco, éste se combina con un fármaco diseñado para repartir el compuesto selectivamente allá donde se localiza la enfermedad.
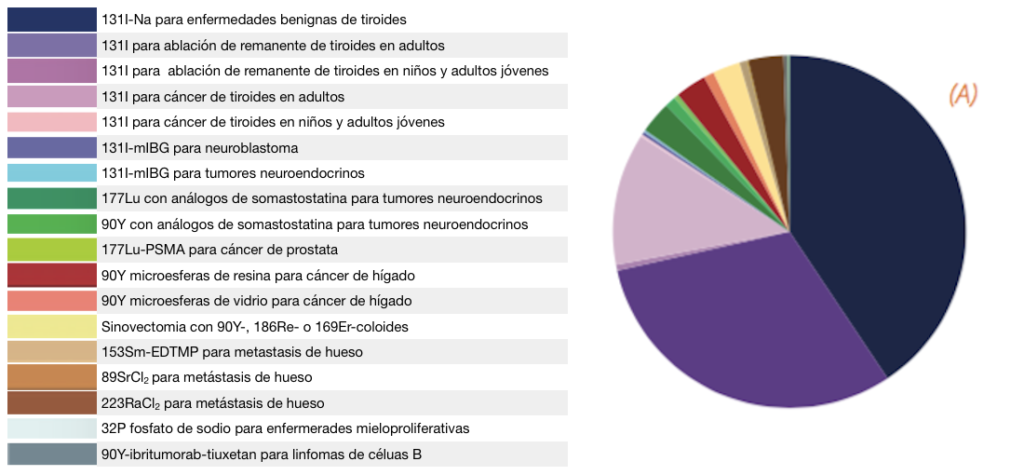
Debido a la especificidad natural del iodo por las tiroides, la terapia con iodo fue la primera en emplearse desde los años 40 del siglo pasado. Éste es, sin lugar a dudas, el tratamiento de radioterapia interna más usado y conocido tal y como refleja la Figura 2.
La misma figura también indica que el abanico de posibles isótopos, fármacos con los que combinarlos y mecanismos de deposición está creciendo enormemente, contribuyendo a una mayor flexibilidad a la hora de aumentar la dosis en las células cancerosas disminuyendo, al mismo tiempo, los efectos secundarios en los tejidos sanos. Este “boom” de la radioterapia interna ha llevado a la comunidad científica a preocuparse por la planificación y verificación de la dosimetría de estos tratamientos, como se realiza de forma rutinaria en los tratamientos de radioterapia externa.
En este contexto aparece la directiva EURATOM2013/59 que establece la necesidad de realizar dosimetrías personalizadas en cualquier tratamiento con radiaciones ionizantes. Pero, ¿por qué no se concibe un tratamiento de radioterapia externa sin una planificación personalizada mientras que en radioterapia interna no se ha establecido aún un procedimiento estándar a nivel europeo? En radioterapia externa la forma y el tamaño del haz se ajusta dinámicamente para diferentes ángulos de irradiación con tal de optimizar la dosis absorbida. En otras palabras, la geometría de la irradiación está definida. En cambio en los tratamientos internos, aunque la teoría no parece complicada, la práctica está llena de dificultades derivadas de la variabilidad entre pacientes. Tras la administración, el radiofármaco se distribuye en el cuerpo de acuerdo con la eliminación biológica de cada paciente y la interacción química de cada cuerpo con cada fármaco, diferente en cada caso y desconocida a priori.
Afortunadamente este problema tiene solución ya que la medicina nuclear tiene el potencial de ofrecer imágenes in vivo de la biodistribución del radioisótopo. Veamos cómo: Los radioisótopos emiten radiación en forma de partículas, principalmente electrones cuyo objetivo es destruir las células blanco. El punto crucial es elegir radionucleidos que al mismo tiempo posean otra característica que nos permita visualizarlos con los equipos apropiados. La característica más obvia es que además sean emisores de fotones. Los fotones interaccionan menos con el medio y, al contrario que los electrones, en su mayoría escapan del cuerpo del paciente lo que nos da la posibilidad de detectarlos. Dicho de modo claro y muy simplificado: los electrones tratan y los fotones nos muestran lo que estamos tratando.
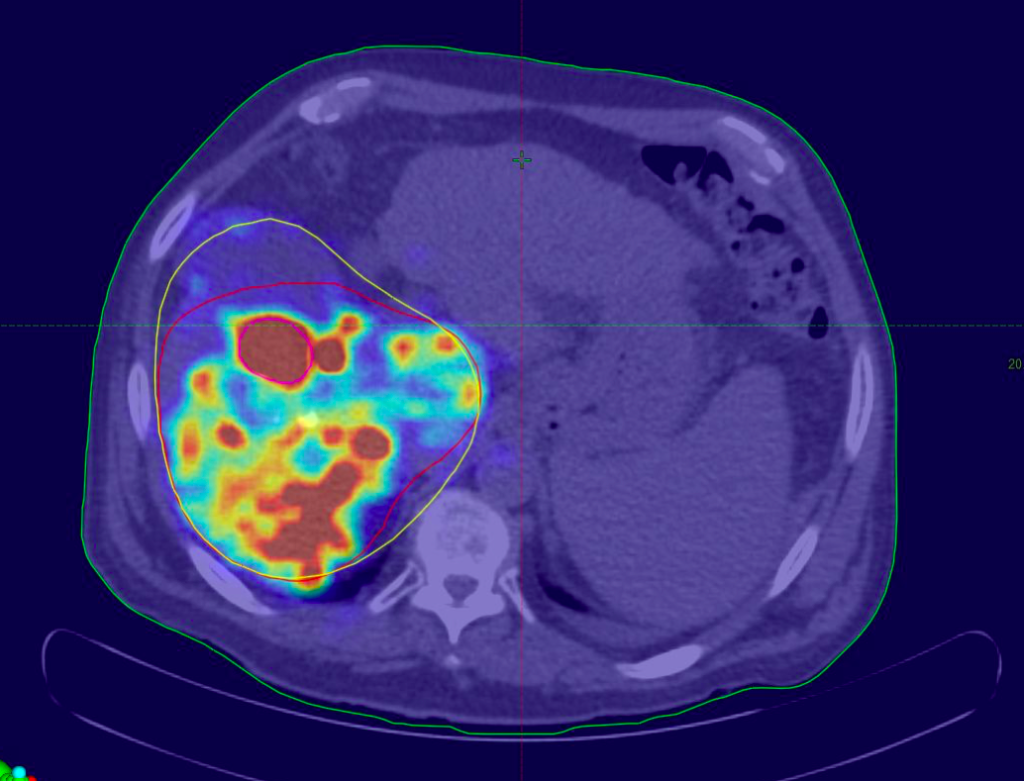
Éste es el punto clave. La dosimetría por imagen se basa en imágenes como la de la Figura 3 que reflejan, no la anatomía del paciente, sino la distribución espacial del radioisótopo en él. Gracias a estas imágenes podemos saberlo casi todo del radioisótopo: adónde ha ido, cuánto se acumula en cada zona y cómo se redistribuye con el tiempo. Así es como somos capaces de realizar dosimetrías post-tratamiento.
Es aún más interesante la posibilidad de realizar dosimetrías pre-tratamiento ya sea mediante trazas del radiofármaco, con una estrategia adaptativa en múltiples ciclos o utilizando un radioisótopo de diagnóstico que sea procesado por el organismo de forma similar. Las dosimetrías pre-tratamiento nos abren la puerta a elaborar planes de tratamiento personalizados pautando la actividad a administrar de tal manera que consigamos ajustar la dosis que recibe el tumor manteniendo a raya la dosis que reciben los órganos de riesgo. No nos cansaremos de repetir que actividad y dosis no son equivalentes y que administrar 7,4 GBq 2 de actividad de Lutecio-177 cada 8 semanas como quien toma 500 mg de ibuprofeno cada 6 horas es lo más lejano a un tratamiento personalizado que uno puede imaginar.
Para terminar, quizás os estéis preguntando: Amén de una directiva europea que nos obliga, ¿Por qué tanto interés en conocer la distribución de dosis en cada paciente? Porque sabemos que el éxito de un tratamiento y los efectos secundarios asociados se correlacionan con la dosis que no es más que la energía absorbida por unidad de masa. Además la no uniformidad de dosis lleva a la existencia de “regiones frías” que pueden implicar la reaparición del tumor a partir de células cancerosas supervivientes. Esta es la razón por la que un requerimiento esencial de cualquier planificación es que las discrepancias entre las distribuciones teóricas de dosis planificadas y reales sean lo mas bajas posibles. Por ello, a pesar de las dificultades técnicas y de recursos, la comunidad de radiofísicos está realizando un gran esfuerzo por personalizar este tipo de tratamientos.
Notas al pie:- A la radioterapia interna también se la conoce como radioterapia molecular, terapia metabólica, terapia con radionucleidos o “target radiotherapy” en inglés. Aún no se han puesto de acuerdo en el nombre.[↩]
- El Becquerel (Bq) es la unidad de actividad radiactiva en el Sistema Internacional de Unidades y equivale a una desintegración nuclear por segundo.[↩]
