Cuando en 2011 pensé en hacer un doctorado, un profesor me desalentó a dedicarme a la física médica, ya que sería en la física del LHC donde se aprovecharía mejor mi potencial. Ignoré el consejo… y encontré en el campo de la medicina mucha más física de la que yo mismo hubiese podido imaginar.
Much@s de l@s que elegimos estudiar la carrera de Física lo hacemos por vocación: nos apasiona estudiar (apoyad@s en las matemáticas) los fundamentos de la realidad, desde los átomos hasta las estrellas. La cinemática, la óptica, la gravedad, la cuántica, la relatividad, el electromagnetismo, la radiactividad… mirándonos en los espejos de Arquímedes, Newton, Galilei, Huygens, Curie, Einstein, Faraday, etc. El descubrimiento de nueva física fundamental; fenómenos, fuerzas, partículas y los intentos de entender lo que medimos pero no nos cuadra, nos estimula a seguir avanzando y a afrontar esas duras clases de espacios de Hilbert, del efecto túnel, de la geometría diferencial y sus geodésicas, del endemoniado cálculo de la vida media del muón partiendo del lagrangiano de Fermi, o incluso del más mundano regulador de bolas.
Con el paso del tiempo y el avistamiento del horizonte laboral, cada uno va encontrando su campo predilecto. En mi caso, y pese a que me presentaran con flores a las ecuaciones de Maxwell (gracias Domingo), fue la curva de Bragg la que cautivó mi interés. Esta curva, publicada en 1904, describe la deposición de energía de un ión positivo acelerado según atraviesa un medio1, con un pico pronunciado cerca del punto donde se frena por completo. Aplicado a la oncología, este fenómeno permite focalizar el daño de un haz de iones acelerados en un punto concreto (el tumor), si se controla bien su profundidad de penetración, cual si de una granada inteligente se tratase. Fue esta bonita intersección de caminos entre física nuclear y oncoterapia la que me motivó a dedicarme profesionalmente a la investigación en física médica2.
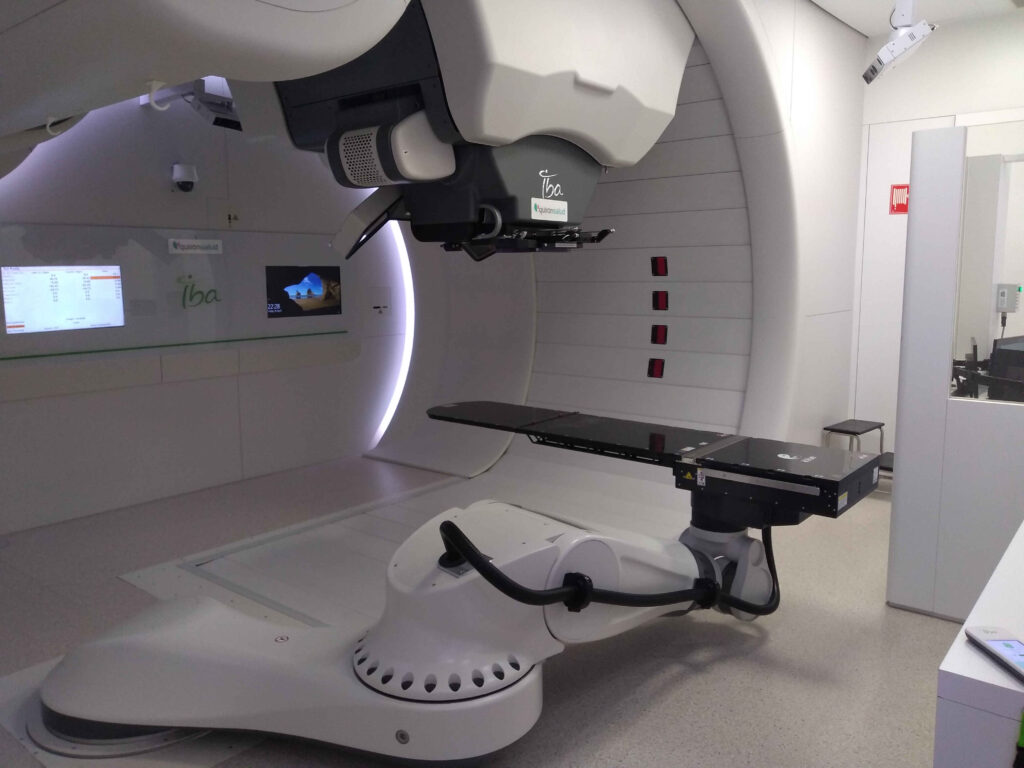
En el caso de España, este tipo de terapia acaba de aterrizar con fuerza (tras años de retraso), con dos centros activos, y diez más planificados. En protonterapia, todo recuerda a la física nuclear y de aceleradores. Los protones se crean a partir de una botella de agua. Tras generarse gas hidrógeno por electrólisis, éste se inyecta a presión en un medidor de ionización de Penning, consistente en dos cátodos en los extremos, un ánodo cilíndrico hueco y un campo magnético axial. De esta manera (regla de la mano derecha), los electrones libres se quedan atrapados entre ambos extremos, moviéndose en espiral. Este ir y venir ioniza parcialmente el gas y lo convierte en un plasma. Algunos iones contribuyen a realimentarlo mediante emisión secundaria de electrones al colisionar con el cátodo. Los protones libres son extraídos y acelerados en un ciclotrón o sincrotrón de decenas de toneladas hasta ⅔ de la velocidad de la luz (230 MeV) en pulsos de 10 nanosegundos.
Utilizando dipolos y cuadrupolos, se dirige el haz de protones hasta el paciente, y unos imanes muy rápidos, como si de una televisión de rayos catódicos se tratase, desvían los protones para que dibujen el tumor a tratar, puntito a puntito. La dosis se controla en tiempo real con cámaras de ionización calibradas previamente con copas de Faraday, y se verifica diariamente en tanques de agua con diodos semiconductores de silicio (tipo p).
Al penetrar en el paciente, la física se vuelve mucho más compleja, pues el haz deja una miríada de partículas secundarias, cual la estela de un cometa. A través de procesos de ionización, el protón deposita la mayor parte de su energía. Radicales libres provocan entonces rupturas en la doble hélice de ADN de las células tumorosas, que es lo que interesa. Pero, además, cuando los proyectiles del haz son capaces de atravesar la barrera de Coulomb (umbral en 10 ó 20 MeV), ocurren miles de reacciones nucleares, elásticas e inelásticas, con los diferentes núcleos del tejido: carbono, hidrógeno, oxígeno, calcio, etc. Como resultado, se generan partículas alfa, neutrones rápidos, deuterones, tritones, radioisótopos, algunos de ellos emisores de positrones. En ciertas reacciones inelásticas, el núcleo resultante queda en un estado excitado, y libera esa energía inmediatamente (en cuestión de picosegundos) en forma de rayos gamma de hasta 6 MeV , conservando momento angular total y paridad.
Esta radiación secundaria, que escapa del paciente a un ritmo de 1.000 millones de fotones (rayos) por segundo, es una mensajera muy útil: si conseguimos deducir su origen espacial con precisión, podemos confirmar que el haz de protones apunta al lugar correcto. Pero del dicho al hecho hay un trecho, y han hecho falta décadas de investigación para aplicar la idea con pacientes. Se han utilizado cristales centelleadores y digitalizadores como los empleados en los calorímetros del CERN, se han explorado cámaras colimadas, cámaras Compton o de producción de pares como en astrofísica, espectroscopía energética y temporal, así como detección de fotones de aniquilación antiparalelos. También se ha ahondado en el estudio de secciones eficaces doble-diferenciales de las diferentes reacciones nucleares, y desarrollado códigos de simulación de Monte Carlo rápidos aprovechando arquitecturas paralelas. Cambiando ahora de tercio, dependiendo del tumor, los médicos utilizan otra técnica que no requiere aceleradores: la braquiterapia. Introduciendo directamente unas semillas pintadas de radioisótopos en el tumor mediante agujas, con una distribución geométrica planificada por radiofísicos, se obtiene un tratamiento altamente localizado y efectivo. Y de nuevo sustentado en multitud de simulaciones de Monte Carlo de electrones y fotones en tejidos orgánicos.
Pero no todo es terapia en física médica. El diagnóstico experimentó un antes y un después con el descubrimiento en 1895 de los rayos X3. Fueron empleados ya en la primera Guerra Mundial para asistir a los heridos, gracias al empeño de Marie Curie. Cien años después, la investigación ha avanzado tanto, que se ha pasado de películas fotográficas, a archivos digitales, y a reconstrucciones 3D tomográficas (TAC) basadas en algoritmos de reconstrucción iterativos muy sofisticados. Hasta el día de hoy, en diciembre de 2021, cuando se ha dado un nuevo salto y se ha introducido el primer TAC comercial de conteo individual, es decir fotón a fotón, cada “cuánto” con su energía, para reducir la dosis irradiada y a la vez mejorar la calidad de la imagen hasta precisiones inimaginables un siglo atrás. En paralelo, la tomografía por emisión de positrones (PET) sigue siendo primordial para una imagen metabólica que complemente la anatómica.
No siempre son necesarios los fotones para obtener una imagen del paciente. Aparte de las ecografías con ultrasonidos, en la segunda mitad del siglo XX se desarrolló la resonancia magnética nuclear, una verdadera revolución por no suponer dosis adicional para el paciente, por su alto contraste de tejidos blandos, y con mucha enjundia física detrás sobre momentos magnéticos y angulares, e imanes superconductores. La técnica se basa en la medida del tiempo de relajación de los espines de los núcleos de hidrógeno del paciente tras someterlos a campos magnéticos enormes, del orden de los tesla.
Si bien en la física médica no hay un bosón de Higgs o neutrino de Majorana por descubrir, me considero un gran afortunado por haberme decantado por esta disciplina: he podido trasladar parte de las habilidades aprendidas en la carrera al campo de la medicina, pero a la vez, y para mí sorpresa, he podido mantener muy cerca mi pasión por la física de partículas, el efecto fotoeléctrico, las reacciones nucleares, los positrones, los rayos gamma y los espines. Y… para bien y para mal, aun queda mucho por hacer.
Notas al pie:- Puede consultarse un artículo celebrando el centenario de la curva de Bragg en este enlace.[↩]
- Recomiendo la lectura de este artículo sobre los orígenes de la física médica.[↩]
- Puede encontrarse un excelente artículo sobre el descubrimiento de los rayos X en este enlace.[↩]

